T.P.1 Exemples de réactions lentes. Facteurs cinétiques.
Dans ce TP, on commence par observer l'évolution de l'avancement d'une transformation chimique lente.
Puis on observe l'influence de la concentration des réactifs et de leur température.
1) Suivi conductimétrique d'une réaction lente.
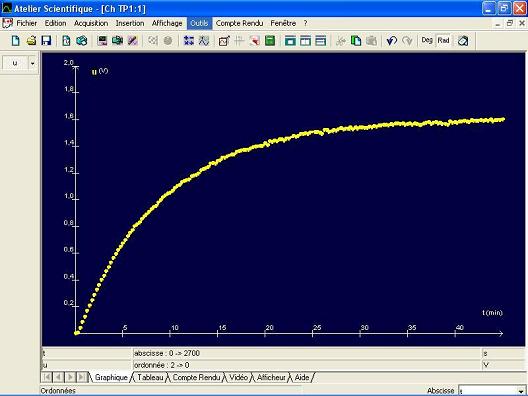
On peut suivre par conductimétrie l'avancement de la transformation car il se forme des ions au cours de celle-ci.
. . . . .
Sachant qu'ici l'avancement x est proportionnel à la tension U délivrée par le conductimètre, on obtient une courbe x(t) ayant même forme que la courbe U(t) obtenue par ExAO.
2) Influence de la concentration (initiale) des réactifs.
On étudie l'évolution d'un même volume de solution contenant des ions thiosulfate et oxonium, lors de la dismutation des ions S2O32- en soufre et en dioxyde de soufre.
On observe que la vitesse de cette réaction augmente avec la concentration des réactifs.
. . . . .
. . . . .
3) Influence de la température.
On étudie l'oxydation de l'acide oxalique par les ions permanganate.
On observe que la vitesse de cette réaction augmente avec la température, car la décoloration du mélange réactionnel est très lente à 0°C, lente à température ambiante et quasi-instantanée à 70°C,